Kā darbojas un darbojas baterijas
 Šī vārda plašākajā nozīmē tehnoloģijā ar terminu "akumulators" tiek apzīmēta ierīce, kas noteiktos darbības apstākļos ļauj uzkrāt noteikta veida enerģiju, bet citos izmantot to cilvēku vajadzībām.
Šī vārda plašākajā nozīmē tehnoloģijā ar terminu "akumulators" tiek apzīmēta ierīce, kas noteiktos darbības apstākļos ļauj uzkrāt noteikta veida enerģiju, bet citos izmantot to cilvēku vajadzībām.
Tos izmanto tur, kur nepieciešams uz noteiktu laiku savākt enerģiju un pēc tam to izmantot lielu darbietilpīgu procesu veikšanai. Piemēram, slūžās izmantotie hidrauliskie akumulatori ļauj kuģiem pacelties jaunā līmenī upes gultnē.
Elektriskie akumulatori strādā ar elektrību pēc tāda paša principa: pirmkārt, tie uzkrāj (uzkrāj) elektroenerģiju no ārēja uzlādes avota un pēc tam nodod to pieslēgtiem patērētājiem, lai tie strādātu. Pēc savas būtības tie pieder pie ķīmiskiem strāvas avotiem, kas spēj atkārtoti veikt periodiskus izlādes un uzlādes ciklus.
Darbības laikā starp elektrodu plākšņu sastāvdaļām nepārtraukti notiek ķīmiskas reakcijas ar to pildvielu - elektrolītu.
Akumulatora ierīces shematisko shēmu var attēlot ar vienkāršotu zīmējumu, kad kuģa korpusā tiek ievietotas divas dažādu metālu plāksnes ar vadiem, lai nodrošinātu elektriskos kontaktus. Starp plāksnēm ielej elektrolītu.
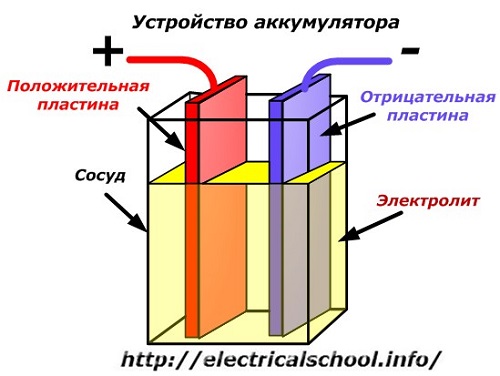
Akumulatora darbība izlādējoties
Kad elektrodiem tiek pievienota slodze, piemēram, spuldze, tiek izveidota slēgta elektriskā ķēde, caur kuru plūst izlādes strāva. To veido elektronu kustība metāla daļās un anjoni ar katjoniem elektrolītā.
Šis process parasti ir parādīts diagrammā ar niķeļa-kadmija elektrodu dizainu.
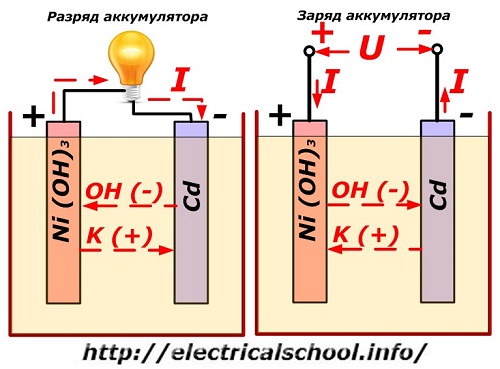
Šeit kā pozitīvā elektroda materiāls tiek izmantoti niķeļa oksīdi ar grafīta piedevām, kas palielina elektrovadītspēju. Negatīvā elektroda metāls ir porains kadmijs.
Izlādes laikā aktīvās skābekļa daļiņas no niķeļa oksīdiem nonāk elektrolītā un tiek novirzītas uz negatīvajām plāksnēm, kur kadmijs tiek oksidēts.
Akumulatora veiktspēja uzlādes laikā
Kad slodze ir izslēgta, plāksnes spailēm tiek pievadīts pastāvīgs (noteiktās situācijās pulsējošs) spriegums ar lielāku vērtību nekā uzlādētam akumulatoram ar tādu pašu polaritāti, kad avota un patērētāja plus un mīnus spailes sakrīt. .
Lādētājam vienmēr ir lielāka jauda, kas "nomāc" atlikušo enerģiju akumulatorā un rada elektrisko strāvu pretējā izlādes virzienā. Tā rezultātā mainās iekšējie ķīmiskie procesi starp elektrodiem un elektrolītu. Piemēram, uz niķeļa-kadmija plākšņu kastes pozitīvais elektrods ir bagātināts ar skābekli, bet negatīvais - līdz tīra kadmija stāvoklim.
Kad akumulators ir izlādējies un uzlādēts, mainās plākšņu (elektrodu) materiāla ķīmiskais sastāvs, bet nemainās elektrolīts.
Akumulatora pieslēgšanas metodes
Paralēlais savienojums
Izlādes strāvas apjoms, ko cilvēks var izturēt, ir atkarīgs no daudziem faktoriem, bet galvenokārt no konstrukcijas, izmantotajiem materiāliem un to izmēriem. Jo lielāks ir plākšņu laukums pie elektrodiem, jo lielāku strāvu tās var izturēt.
Šo principu izmanto, lai paralēli savienotu viena veida šūnas akumulatoros, kad nepieciešams palielināt strāvu līdz slodzei.Bet, lai uzlādētu šādu dizainu, būs jāpalielina avota jauda. Šo metodi reti izmanto gatavām konstrukcijām, jo tagad ir daudz vieglāk nekavējoties iegādāties nepieciešamo akumulatoru. Bet skābes akumulatoru ražotāji to izmanto, savienojot dažādas plāksnes atsevišķos blokos.
Seriālais savienojums
Atkarībā no izmantotajiem materiāliem starp abām ikdienā bieži sastopamajām bateriju elektrodu plāksnēm var tikt radīts 1,2/1,5 vai 2,0 voltu spriegums. (Patiesībā šis diapazons ir daudz plašāks.) Acīmredzot ar to nepietiek daudzām elektriskām ierīcēm. Tāpēc viena veida akumulatori ir savienoti virknē, un tas bieži tiek darīts vienā gadījumā.
Šādas konstrukcijas piemērs ir plaši izplatītā automobiļu izstrāde, kuras pamatā ir sērskābes un svina elektrodu plāksnes.
Parasti cilvēku vidū, īpaši transporta šoferu vidū, par akumulatoru pieņemts saukt jebkuru ierīci neatkarīgi no to veidojošo elementu – kastīšu skaita. Tomēr tas nav pilnīgi pareizi.Konstrukcija, kas salikta no vairākām sērijveidā savienotām kastēm, jau ir akumulators, kuram uzlīmēts saīsinātais nosaukums «АКБ»... Tās iekšējā uzbūve parādīta attēlā.
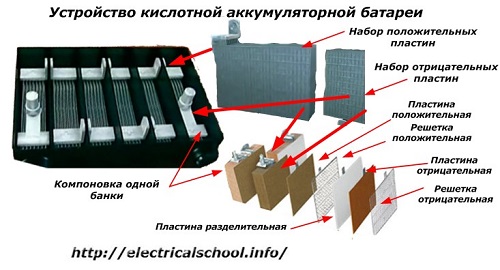
Katra burka sastāv no diviem blokiem ar plākšņu komplektu pozitīvajiem un negatīvajiem elektrodiem. Bloki iederas viens otrā bez metāla saskares ar iespēju izveidot uzticamu galvanisku savienojumu caur elektrolītu.
Šajā gadījumā kontaktplāksnēm ir papildu režģis, un tās viena no otras atdala ar atdalīšanas plāksni.
Plākšņu savienošana blokos palielina to darba laukumu, samazina visas konstrukcijas kopējo pretestību un ļauj palielināt pievienotās slodzes jaudu.
Kastes ārpusē šādam akumulatoram ir elementi, kas parādīti attēlā zemāk.
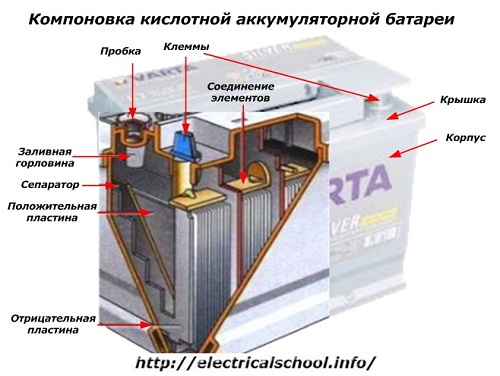
Tas parāda, ka izturīgais plastmasas korpuss ir noslēgts ar vāku un aprīkots ar diviem spailēm (parasti konusa formas) augšpusē savienošanai ar automašīnas elektrisko ķēdi. Uz to spailēm ir uzspiests polaritātes marķējums: «+» un «-«. Parasti pozitīvajam spailei ir nedaudz lielāks diametrs nekā negatīvajam, lai bloķētu elektroinstalācijas kļūdas.
Apkalpojamiem akumulatoriem katras burkas augšpusē ir iepildīšanas atvere, lai kontrolētu elektrolīta līmeni vai pievienotu destilētu ūdeni darbības laikā. Tajā ir ieskrūvēts spraudnis, kas aizsargā korpusa iekšējos dobumus no piesārņojuma un vienlaikus novērš elektrolīta izlīšanu, kad akumulators ir sasvērts.
Tā kā ar spēcīgu uzlādi ir iespējama gāze no elektrolīta (un šis process ir iespējams intensīvas braukšanas laikā), aizbāžņos tiek izveidoti caurumi, lai nepieļautu spiediena palielināšanos kastes iekšpusē.Caur tiem izplūst skābeklis un ūdeņradis, kā arī elektrolītu tvaiki. Ieteicams izvairīties no šādām situācijām, kas saistītas ar pārmērīgu uzlādes strāvu.
Tajā pašā attēlā parādīts elementu savienojums starp bankām un elektrodu plākšņu izvietojums.
Automašīnu startera akumulatori (svina skābe) darbojas pēc dubultās sulfācijas principa. Izlādes / uzlādes laikā uz tiem notiek elektroķīmisks process, ko papildina elektrodu aktīvās masas ķīmiskā sastāva izmaiņas ar ūdens izdalīšanos / absorbciju elektrolītā (sērskābē).
Tas izskaidro elektrolīta īpatnējā smaguma palielināšanos lādēšanas laikā un samazināšanos, kad akumulators ir izlādējies. Citiem vārdiem sakot, blīvuma vērtība ļauj novērtēt akumulatora elektrisko stāvokli. Tās mērīšanai tiek izmantota speciāla ierīce – auto hidrometrs.
Destilēts ūdens, kas ir skābes akumulatoru elektrolīta sastāvdaļa, pie negatīvas temperatūras pārvēršas cietā stāvoklī – ledū.Tāpēc, lai aukstā laikā nepieļautu automašīnu akumulatoru aizsalšanu, nepieciešams piemērot īpašus noteikumos paredzētos pasākumus. izmantošanai.
Kādi bateriju veidi pastāv?
Mūsdienu ražošana dažādiem mērķiem ražo vairāk nekā trīs desmitus produktu ar dažādu elektrodu un elektrolītu sastāvu. 12 zināmie modeļi darbojas tikai ar litiju.

Kā elektrodu metālu var atrast:
-
svins;
-
dzelzs;
-
litijs;
-
titāns;
-
kobalts;
-
kadmijs;
-
niķelis;
-
cinks;
-
Sudrabs;
-
vanādijs;
-
alumīnija
-
daži citi priekšmeti.
Tie ietekmē elektriskās izejas raksturlielumus un līdz ar to arī pielietojumu.
Svina-skābes akumulatoriem raksturīga spēja izturēt īslaicīgas lielas slodzes, kas rodas no iekšdedzes dzinēju kloķvārpstu rotācijas ar elektrisko startera motoru palīdzību. Tos plaši izmanto transportā, nepārtrauktās barošanas avotos un avārijas energosistēmās.
Standarta galvaniskās šūnas (parastās baterijas) parasti tiek aizstātas ar niķeļa-kadmija, niķeļa-cinka un niķeļa-metāla hidrīda akumulatoriem.
Bet litija jonu vai litija polimēru konstrukcijas droši darbojas mobilajās un skaitļošanas ierīcēs, celtniecības instrumentos un pat elektriskajos transportlīdzekļos.
Atkarībā no izmantotā elektrolīta veida baterijas ir:
-
skābs
-
sārmains.
Ir bateriju klasifikācija pēc mērķa. Piemēram, mūsdienu apstākļos ir parādījušās ierīces, kuras izmanto enerģijas pārnešanai — citu avotu uzlādēšanai. Tā sauktais ārējais akumulators palīdz daudzu mobilo ierīču īpašniekiem, ja nav mainīga elektrotīkla. Tas spēj atkārtoti uzlādēt planšetdatoru, viedtālruni, mobilo tālruni.
Visām šīm baterijām ir vienāds darbības princips un līdzīga ierīce. Piemēram, litija jonu pirkstu modelis, kas parādīts attēlā zemāk, daudzējādā ziņā atkārto iepriekš apspriesto skābes akumulatoru dizainu.
Šeit mēs redzam tos pašus kontaktu elektrodus, plāksnes, separatoru un korpusu. Tikai tie ir izgatavoti, ņemot vērā citus darba apstākļus.
Akumulatora pamata elektriskie raksturlielumi
Ierīces darbību ietekmē parametri:
-
jauda;
-
enerģijas blīvums;
-
pašizlāde;
-
temperatūras režīms.
Ietilpību sauc par akumulatora maksimālo uzlādi, ko tas spēj dot izlādes laikā līdz zemākajam spriegumam. To izsaka piekariņos (SI sistēma) un ampērstundās (nesistēmas mērvienībā).
Kā jaudas veids ir «enerģijas jauda», kas nosaka izlādes laikā izdalīto enerģiju līdz minimālajam pieļaujamajam spriegumam. To mēra džoulos (SI) un vatstundās (vienības, kas nav SI).
Enerģijas blīvums, kas izteikts kā enerģijas daudzuma attiecība pret akumulatora svaru vai tilpumu.
Pašizlāde ņem vērā jaudas zudumu pēc uzlādes, ja termināļiem nav slodzes. Tas ir atkarīgs no konstrukcijas, un to pastiprina izolācijas pārrāvumi starp elektrodiem daudzu iemeslu dēļ.
Darba temperatūra ietekmē elektriskās īpašības un nopietnu noviržu gadījumā no ražotāja norādītās normas var sabojāt akumulatoru. Karstums un aukstums ir nepieņemami, tie ietekmē ķīmisko reakciju gaitu un apkārtējās vides spiedienu kastes iekšpusē.
